Tumeurs | Parties Molles | Tumeur desmoide
CAS
Jeune femme de 17 ans, sans antécédent notable, présentant une tuméfaction progressivement croissante de la face postérieure de la racine de cuisse gauche. Pas de contexte traumatique. Echographie non contributive.
Un complément d’imagerie par IRM est réalisé :
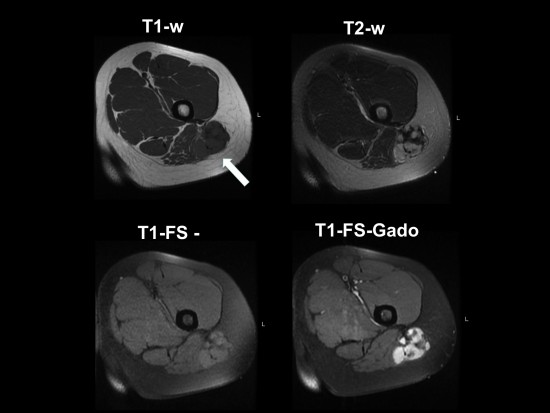
L’IRM montre une lésion unique de la face postérieure et proximale de cuisse gauche, sous-aponévrotique, dans la loge postérieure de cuisse, intramusculaire envahissant la face externe du muscle grand fessier gauche (flèche blanche).
Elle mesure 5cm de plus grand axe.
Elle présente un signal augmenté en T2 par rapport au muscle, un iso-signal T1 par rapport au muscle, un rehaussement marqué et homogène après injection de Gadolinium. Il n’est pas vu de nécrose, de saignement, de composante myxoide ou nécrotique, ni d’envahissement osseux, vasculaire ou aponévrotique.
Ses contours sont polylobés et bien limités.
Il n’y a pas d’œdème périlesionnel.
Devant l’absence d’éléments spécifiques en imagerie, une biopsie échoguidée est réalisée. L’analyse anatomopathologique rapporte le diagnostic de tumeur desmoide intramusculaire en phase active.
DISCUSSION
Les tumeurs desmoides sont des tumeurs fibreuses bénignes des parties molles d’évolution lente et à potentiel d’agressivité uniquement locale.
Trois formes sont décrites :
- Forme abdominale : typiquement chez la femme jeune lors d’une grossesse, ou dans les suites d’un geste chirugical, d’un traumatisme, de radiothérapie…
- Formes extra-abdominales : épaule (20%), paroi thoracique (15%), cuisse (12%)…
- Formes intra-abdominales (pelvienne, mésentérique, rétropéritonéale)
Les tumeurs desmoides sont le plus souvent uniques et sporadiques. Toutefois, les tumeurs desmoides de formes intra abdominales peuvent s’intégrer dans le syndrome de Gardner, associant polypose adénomateuse familiale, ostéomes crâniens et maxillaires, anomalies dentaires, fibromes du cuir chevelu, des épaules, des bras et du dos.
Imagerie
L’imagerie de choix est l’IRM avec des séquences T1, T2, avec saturation de graisse, et injection de chélates de gadolinium.
Typiquement, la tumeur présente des berges spiculées, expansives et rétractiles sur les tissus et fascias environnant. Elle infiltre les muscles et les tissus. Elle peut s’étendre le long de fascias donnant un ‘tail sign’, signe rare par ailleurs, aussi retrouvé dans les myxofibrosarcomes et les fasciites nodulaires.
Le signal est souvent hétéréogène et variable selon la phase d’activité de la tumeur :
-hyperintense et se rehaussant en cas de tumeur active, croissante, cellulaire
-hypointense en T1 et en T2 en cas de forme chronique, faiblement cellulaire, très fibreuse.
Des calcifications sont rares mais possibles.
Il n’y a pas de nécrose, de saignement, de nécrose ou de composante myxoide.
Il est essentiel de préciser :
- l’existence de nodules satellites car ils sont fréquemment impliqués dans les récidives
- un rehaussement après injection, car il témoigne d’une activité de la tumeur.
Diagnostic
Le diagnostic est confirmé par une biopsie avec examen anatomopathologique.
En histologie : elle correspond à une prolifération de fibroblastes et myofibroblastes bien différenciés dans une trame de tissus collagène. En immunohistochimie, on retrouve l’expression de cellules musculaires à savoir d’actine, vimentine, desmine, e l’absence de CD34. Deux mutations sont recherchées : du gène CTNNB1 codant pour la beta catenine (présente dans 85% des cas), et APC dont certaines mutations sont responsables impliquées dans la polypose adénomateuse familiale et le syndrome de Gardner.
Prise en charge
La prise en charge doit prendre en compte le risque de récidive en cas de résection chirurgicale (30-40%). Des alternatives peuvent être proposées : chimiothérapies, inhibiteur de tyrosine kinase, hormonothérapie, radiothérapie, cryoablation en radiologie interventionnelle.
Une surveillance régulière, clinique et IRM tous les 3 à 6 mois, doit être programmée
Le risque de rechute locale est estimé à 70%.
REFERENCES
* Cotten et al. Imagerie musculosquelettique : Pathologies générales. 2ième édition, 2013. Edition Elsevier Masson
* Shinagare AB1, Ramaiya NH, Raut CP et al. A to Z of desmoid tumors. AJR Am J Roentgenol. 2011 Dec;197(6)
* http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=FR&Expert=873
* Murphey MD1, Ruble CM, Miettinen M et al. From the archives of the AFIP: musculoskeletal fibromatoses: radiologic-pathologic correlation. Radiographics. 2009 Nov;29(7):2143-73.
* Escobar C1, Munker R, Burton GV et al. Update on desmoid tumors. Ann Oncol. 2012 Mar;23(3):562-9.
* Schmitz JJ1, Schmit GD1, Morris JM1 et al. Percutaneous Cryoablation of Extraabdominal Desmoid Tumors: A 10-Year Experience. AJR Am J Roentgenol. 2016 Jul;207(1):190-5.



